白血病占儿童肿瘤首位!科学家联合使用免疫细

今年3月20日,《国家儿童肿瘤监测年报2020》正式发布,其收录了全国313家儿童肿瘤监测点的32万9093张儿童肿瘤病例报告卡,分析了出院时间为2017年1月至2018年12月的恶性肿瘤、中枢神经系统良性肿瘤的病例信息。结果显示,白血病仍然是儿童患病人群最多的重大恶性疾病,占比为57.21%。
诚然,近年来随着诊断分型技术的提高、化疗药物和方案的改进,儿童急性淋巴细胞白血病的生存率已经有了很大的提高,据统计,患儿长期无病生存率已达90%。但我们仍要看到,有10%~15%的急性淋巴细胞白血病患儿为复发或难治类型,并成为儿童急性淋巴细胞白血病的主要死因。
具体来说,儿童急性淋巴细胞白血病在首次复发后5年生存率仅30%~50%,初诊成人急性淋巴细胞白血病5年生存率约40%,复发后的5年生存率仅有10%。因此,攻克复发型难治型急性淋巴细胞白血病的治疗难题成了科学界的共同目标[1]。
免疫疗法给患儿给来希望
CAR-T细胞治疗是一种基于细胞水平的靶向治疗,其利用了人体T淋巴细胞的天然功能。这些来自患者或供体的T淋巴细胞经工程化改造表达特异性的CAR,可以识别特异的肿瘤表面抗原,T细胞活化后可以靶向攻击相关的抗原(如CD19/CD20等)导致肿瘤细胞死亡,从而达到治疗白血病的效果[2]。
早在2013年,科学家们就报道了用CD19阳性CAR-T细胞治疗2例经异基因造血干细胞移植治疗后复发及难治性急性淋巴细胞白血病的患儿,结果显示两例患儿都达到了完全缓解,初步证实了CAR-T细胞治疗儿童急性淋巴细胞白血病的安全性和有效性[3]。
2014年,相关研究人员在30例白血病患者中继续展开CAR-T细胞治疗,其中儿童急性淋巴细胞白血病患者25例,有15名患者接受了干细胞移植,该临床研究结果显示CAR-T细胞治疗的有效率高达90%,6个月的无事件生存率达67%,总生存率达78%,客观缓解率甚至达到了90%[4]。
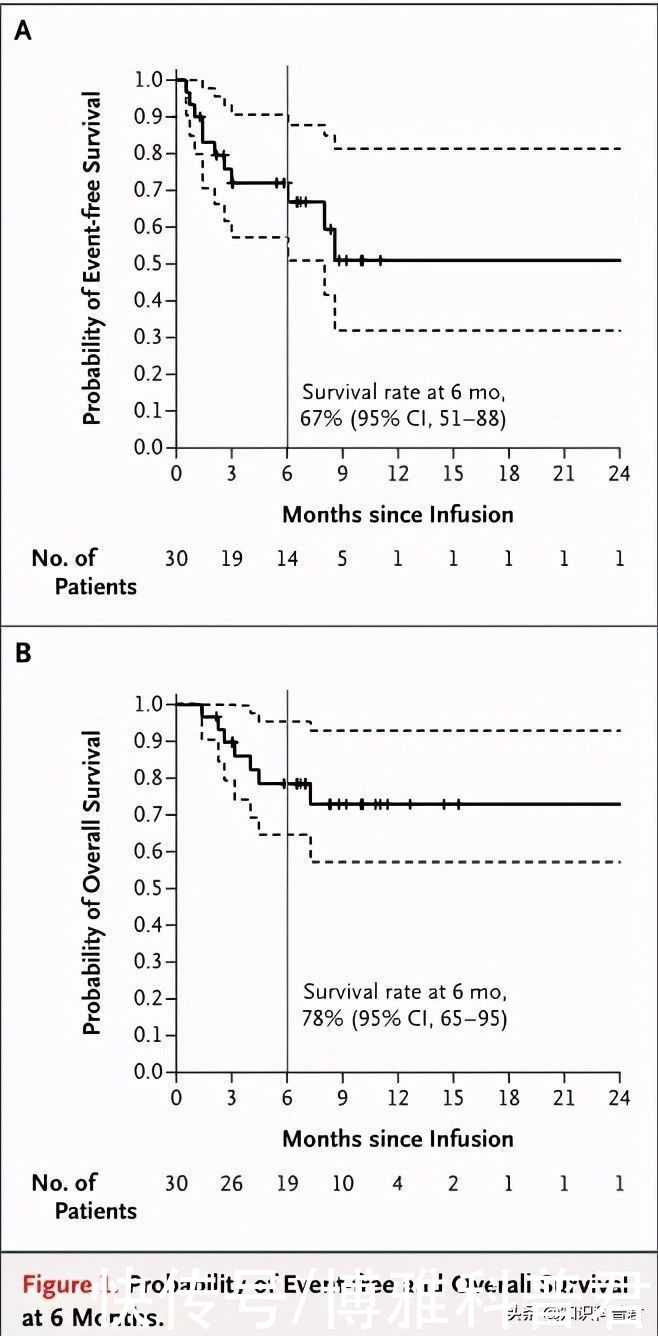
图片来源于文献[4]
6个月的无事件生存率和总生存率
在2017年,CAR-T细胞治疗药物成为美国首个获批的治疗儿童及青少年复发和(或)难治型急性淋巴细胞白血病的基因疗法,宣告CAR-T细胞治疗再次取得了阶段性的里程碑[4]。
BoyaLIVECAR-T免疫治疗无癌8年幸存者Emily给中国发来视频 #免疫细胞视频号
还记得那个因化疗不敏感接受CAR-T细胞治疗的女孩——艾米莉吗?如今她已无癌生存8年,在生命垂危之际接受CAR-T细胞治疗的这个决定,成为了她人生的转折点。
CAR-T 细胞联合干细胞
的确,CAR-T免疫疗法在近年来的临床试验中表现出其对急性淋巴细胞白血病具有良好的靶向性、杀伤力及持久性,但它也有着不容忽视的副作用,可能会引起很多近期和远期的不良反应,也不能完全解决治疗后的复发问题。
面对这一棘手现况,科学家们从优化CAR-T细胞的设计、建立合理的预处理和细胞输注临床方案,以及与其他治疗方案联合应用着手,期望能进一步提高CAR-T细胞治疗的安全性和有效性,为复发难治型急性淋巴细胞白血病的治疗提供新方案。
近期,发表于《临床肿瘤学杂志》题为“Long-Term Follow-Up of CD19-CAR T-Cell Therapy in Children and Young Adults With B-ALL”的这篇文章就是科学家们的最新成果之一。

Tisagenlecleucel是一种靶向CD19的CAR-T细胞产品,这项针对儿童青少年复发难治型B细胞急性淋巴细胞白血病患者的全球性II期临床试验结果显示,在Tisagenlecleucel输注后第28天,患者的完全缓解率高达82%。中位随访时间为13.1个月时,获得完全缓解的患者中有59%的患者仍处于完全缓解状态,大多数患者以CD19阴性形式复发。而接受CAR-T细胞治疗后达到MRD阴性的28例患者中有21例(75%)后续桥接了异基因造血干细胞移植(Allo-HSCT)巩固治疗,接受Allo-HSCT治疗的患者的中位总生存期为70.2个月, 24个月时的累积复发率仅为9.5%。
这项研究表明了自体CD19 CAR-T细胞疗法后桥接异基因造血干细胞移植(Allo-HSCT)巩固治疗可改善B细胞急性淋巴细胞白血病患者的长期无事件生存率,且具有明显的平稳期和较低的复发率,提示这一治疗方案可以使这些患者得到长期持续的疾病控制,裨益深远[5]。
文章来源:《肿瘤》 网址: http://www.zlzzs.cn/zonghexinwen/2021/0512/1313.html