干货分享 | 如何在肺肿瘤微环境中构建基质细胞
前 言
癌旁的基质细胞,如巨噬细胞,T细胞和纤维母细胞,组成了肿瘤的微环境。肿瘤微环境是一个极其复杂的细胞生态系统,但是这些基质细胞的异质性,以及基质和肿瘤细胞之间的相互影响都还没有明确的研究成果。
人们意识到某些基质癌旁细胞也可以作为癌症新的治疗方案的靶点,非小细胞肺癌(NSCLC)患者就可以从此方法中获益。
实验方法
1、单细胞悬液制备
五名未治疗的的非转移性非小细胞肺癌(NSCLC)患者,每名患者都有不同程度的的慢性阻塞性肺疾病(COPD),手术切除选取每个患者的三个肿瘤组织,以及其中4名患者的非恶性组织样本作为研究样本。切除后样本用PBS清洗,将每个肿瘤组织分成3份:肿瘤中心组织、肿瘤边缘及二者的连接处的组织。
将样本在冰上剪成小于1mm的碎块,然后用10ml消化液进行消化处理(含0.2%的胶原酶I/II、DNAseI和25 units中性蛋白酶的DMEM),37℃,15min。PBS重悬后过40um筛网,离心,弃上清;红细胞裂解,离心(水平转子)弃上清,用0.4%BSA的PBS重悬,过40-μ m cell strainers,测活性。
2、单细胞测序
用10x Genomics的Chromium Single Cell 3’ Library kit构建文库,每个文库回收4,000 cells,用Illumina HiSeq4000测序仪测序。
3、生物信息学分析
结果分析
1、肺肿瘤和非恶性组织的scRNA-seq结果及细胞类型
本文对5位患者,19个样本(15+4)进行研究(fig.1a),共52,698个细胞进行单细胞转录组分析,有 cells (75%)来源于肺肿瘤组织,个来源于非恶性的肺组织细胞(Fig.1a,b)。通过对2200个差异表达的基因进行PCA分析,将细胞分成了8种不同的亚群,包括癌细胞、免疫细胞(骨髓细胞、T细胞和B细胞)、纤维母细胞、内皮细胞、肺泡细胞和上皮细胞。这些细胞的转录活性有显著差异,每个T cell有1,678 trans (764 genes),每个cancer cell有6,746 trans (1,828genes) (Fig.1c,d)。此外,作者还对另一名患者的肿瘤和非恶性肺部样本进行bulk RNA-seq,发现与单细胞RNA-seq数据结果有很好的相关性。

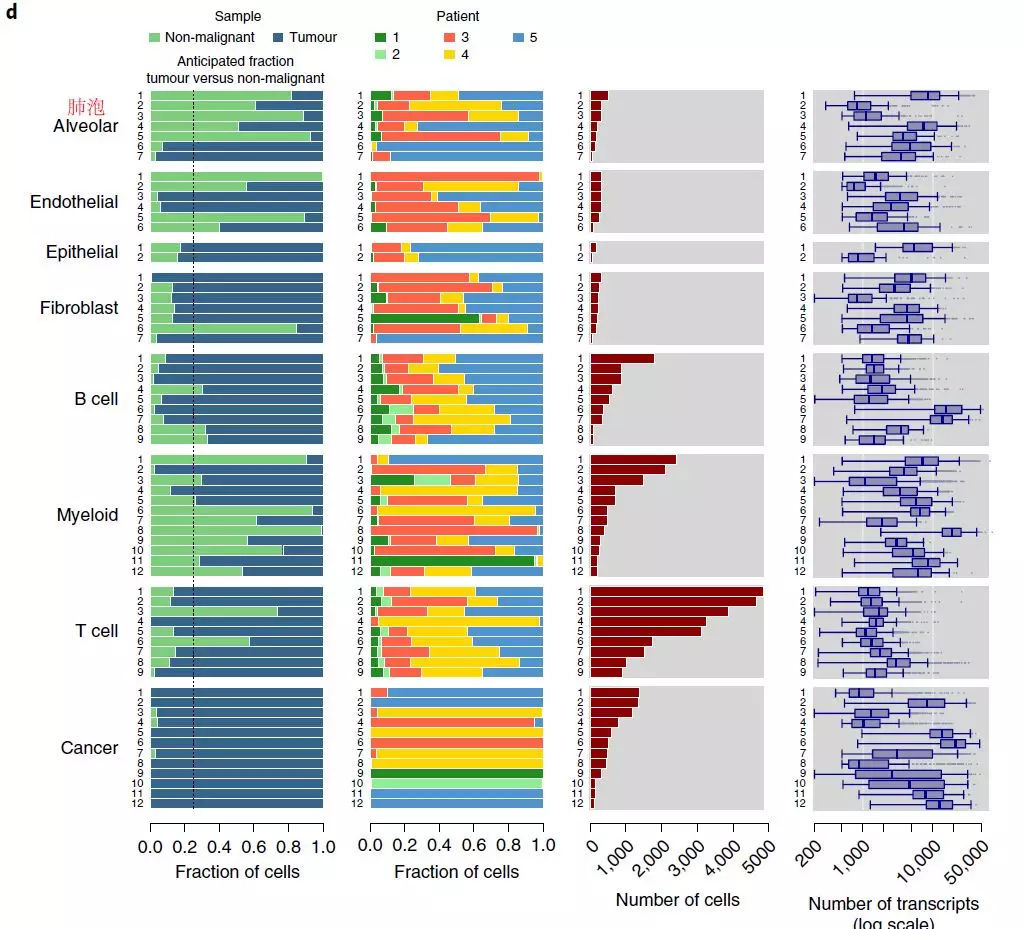
Fig. 1 | Overview of the 52,698 single cells from lung tumors and distal non-malignant lung samples
a.取样患者的基本信息; b.52,698个细胞的t-SNE图,包括细胞来源(肿瘤/非肿瘤)、病人分布、细胞类型以及转录本的表达丰度(UMIs); c.不同基质细胞亚群marker gene表达图; d. 52种基质细胞亚型和12种癌细胞亚群的细胞与转录本在不同细胞类群、组织类型、病人等的分布。
通过对不同类型细胞的基因表达做进一步的分析,发现了一个复杂的细胞生态系统,由52种基质细胞亚型和12种癌细胞亚群组成。虽然癌细胞亚群有高度的病人特异性,但却在几个患者中均发现了相同的基质细胞亚群,即基质细胞亚型主要由3位患者的细胞构成(患者3/4/5)(Fig.1d)。通过比较分析肿瘤和其对应的非恶性肺组织结果,研究人员发现,许多基质细胞亚群富含肿瘤衍生细胞或者肺组织衍生细胞。为了验证这一发现,他们又对3名NSCLC患者进行了约个细胞的单细胞RNA-seq,并发现了之前已经发现的52种中的45种基质细胞亚群。(S Fig. 5)
因此,本文将进一步探究主要基质细胞亚型的变化。
2、肿瘤内皮细胞下调免疫归巢/吸引通路(attraction pathways)
对1592个内皮细胞(Ec)进行分析,得到了6 clusters,并发现Ec在肿瘤中呈现低丰度(Fig.2a)。对每个cluster的marker gene进行鉴定,在肿瘤和非恶性样本中发现了85个淋巴内皮细胞(cluster 6; marker genes PDPN and PROX1);5组血液内皮细胞:2组主要由肿瘤衍生(clusters 3 and 4; IGFBP3+and SPRY1+),另2组是非恶性肺组织衍生(clusters 1 and 5; MT2A+ and EDNRB+)(Fig. 2a,b; SFig. 6),剩下的1组无marker gene(clusters 2)。当评估108个非恶性肺的bulk RNA-Seq中的marker gene的表达时,在TCGA中列出的501个LUSC或513个LUAD肿瘤,正常和肿瘤内皮细胞的marker gene分别在非恶性肺和肺肿瘤中富集(Fig. 2c)。肿瘤和正常内皮细胞比较发现Myc(原癌细胞)在肿瘤Ec中靶向富集(Fig. 2d)。
对Ec转录本表达丰度进行研究发现肿瘤Ec有较高的RNA含量是由于转录速率增加(Fig. 2e,S Fig.9)。进一步研究揭示了基因下调与免疫激活和免疫细胞归巢相关,重要的是,内皮细胞是循环免疫细胞与肿瘤之间的主要接口,在传递信号和从组织中呈递抗原表位起到重要作用。下调的基因类包括抗原呈递(主要组织相容性复合体Ⅰ和II),趋化性(CCL2, CCL18, IL6) 和免疫细胞归巢(ICAM1) (Fig. 2f)。以上结果表明肿瘤Ec被重塑以下调其抗原呈递和免疫细胞归巢活性,从而有助于肿瘤的免疫耐受。
文章来源:《肿瘤》 网址: http://www.zlzzs.cn/zonghexinwen/2020/1027/545.html